幼儿园游戏大全_幼儿园游戏活动教案
2023-10-22 23:09:26
电解池的工作原理,原电池的工作原理图
电解池是一种常见的电化学设备,它通过将电能转化为化学能来实现电解反应。在电解池中,有两个电极:阳极和阴极,分别连接到电源的正负极。同时,在电解液中存在着离子,它们能够在电场的作用下移动。当电源接通时,阴极成为电源的负极,而阳极成为电源的正极。在这个过程中,离子将从电解液中移动到电极上,发生氧化和还原反应。电子流经电路,从阴极流向阳极,同时离子在电解液中传导,生成新的物质。这个电解反应的过程便是电解池的工作原理。通过电解池的运作,我们能够实现金属的电镀、水的电解制氢等众多实际应用。
一:电解池的工作原理
一、电解池的工作原理 外接电源在工作时,电子从负极流出,在与之相连的电极上,引发一个得电子的还原反应,我们称之为阴极; 最终电子要流入电源的正极,势必在与正极相连的电极上,引发一个失电子的氧化反应,我们称之为阳极。
二、电子流向及离子流向问题 导线中,电流的产生是电子流动的结果。溶液中,电流的产生是阴、阳离子流动的结果。阳离子流向与电流流向保持一致,而阴离子与电子由于带负电荷,其流动方向与电流流向相反。(即:导线中电子的流向为:电源负极流向电解池的阴极,电解池的阳极流向电源的正极;而溶液中阳离子流向为电解池的阳极流向阴极,阴离子流向为电解池的阴极流向阳极)
三、电极反应式及电解反应总方程式的书写 阳极发生失电子的反应,粒子的放电顺序为:活性电极材料S2->I->Br->Cl->OH->含氧酸根>F- 阴极发生得电子的反应,粒子的放电顺序为:Ag+>Fe3+>Cu2+>H+ 注意:在书写电极反应式时,我们可以毫不犹豫地用实际放电的离子表示(也可用弱电解质分子表示放电微粒);但在书写电解反应总方程式时,如果放电离子来自弱电解质,则用弱电解质的分子式来表示。
比如:电解NaCl溶液时,阳极反应式:2Cl--2e-=Cl2↑;阴极反应式:2H++2e-=H2↑(也可写成:2H2O+2e-=H2↑+2OH-)。整合两电极反应式,得电解反应总方程式时,不可写成:2Cl-+2H+ = H2↑+Cl2↑,因2H+来自弱电解质,应为:2Cl-+2H2O = H2↑+Cl2↑+2OH-。试写出下列过程的电极反应式及电解反应方程式:电解 *** 铜溶液、电解硝酸银溶液,电解盐酸溶液、电解氯化铜溶液,电解硝酸钠溶液、电解氢氧化钠溶液,电解熔融的氯化镁、电解熔融的氧化铝。
四、电解质溶液的复原(原则是“出去什么补什么”) 如:氯化钠溶液电解后,析出氢气和氯气,若要电解质溶液复原,需往电解后的溶液中通往氯化氢气体,而不可以是盐酸溶液。 再如: *** 铜溶液电解时,从体系中脱离的物质有Cu和O2,若要使电解质溶液复原,则需往电解后的溶液中加入CuO,而不能加入Cu(OH)2,但可以加入CuCO3(思考为什么?) 硝酸银溶液电解后,需加什么物质才可以使电解质溶液复原呢?
例题:用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后,恰好恢复到电解前的浓度和PH,则电解过程中,转移电子数为多少?阳极产生气体多少L?阴极产生气体多少L?
五、电解后,溶液PH值的变化 原则是看电解时有没有氢气和氧气产生。如果电解时,只有氢气,而不放出氧气,则PH定会增大;如果电解时,只有氧气,而不放出氢气,则PH必定减小;如果同时产生氢气和氧气,则相当于电解水,此时PH随溶质的浓度的增大而变化。若电解的是溶质,则相当于给溶液稀释,如电解CuCl2溶液。
六、电解原理的应用 铜的电解精炼原理,应明确:阴阳极电极材料及电极反应式的书写,溶液中Cu2+浓度的变化情况,以及阳极泥的形成。 电镀的原理、阴阳极材料及电解质溶液的变化。
七、关于电化学的计算问题 计算核心:各串联电极上转移的电子数相等,依据这一点,我们得出电极上析出物质及溶液中放电微粒的对应关系,如:O2~2Cl2~2H2~2Cu~4Ag~4H+~4OH
二:原电池的工作原理是什么
在高中阶段来说,原电池是将化学能直接转化为电能的一种装置。其原理也是通过化学反应(在正负极发生不同的氧化还原反应)使闭合电路中产生电子流,从而产生电流的。其中在正极发生还原反应,负极发生氧化反应。
三:原电池的工作原理教案
2017年,全国一卷,6分 11.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
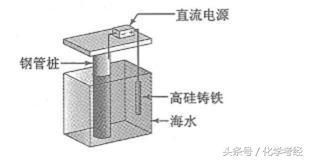
A通入保护电流使钢管桩表面腐蚀电流接近于零
B通电后外电路电子被强制从高硅铸铁流向钢管桩
C高硅铸铁的作用是作为损耗阳极材料和传递电流
D通入的保护电流应该根据环境条件变化进行调整
正确答案
C
解析
本题使用的是外加电流的阴极保护法:
(1)A.被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱腐蚀的发生,故A正确;
(2)B.通电后,惰性高硅铸铁作阳极,海水中的氯离子等在阳极失电子发生氧化反应,电子经导线流向电源正极,再从电源负极流出经导线流向钢管桩,故B正确;
(3)C.高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,C错误;
(4)D.在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,故D正确;
考查方向
原电池和电解池的工作原理
解题思路
外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极,电子从电源负极流出,给被保护的金属补充大量的电子,使被保护金属整体处于电子过剩的状态,让被保护金属结构电位低于周围环境,从而使得金属腐蚀发生的电子迁移得到抑制,避免或减弱腐蚀的发生,阳极若是惰性电极,则是电解质溶液中的离子在阳极失电子,据此解答.
易错点
理解外加电流阴极保护法的工作原理,注意化学与生活的联系.
四:原电池的工作原理图
原电池的工作原理:将氧化~还原反应分置在两极上进行,负极发生氧化反应,失去的电子通过导线传递到正极,电解质中的氧离子或氧化性物质在正极上得电子发生还原反应。电解质中阴离子向负极移动,从而整个电路中都有电荷的定向移动,所以实现了化学能向电能的转化。
原电池的条件:两种不同的电极。处在同一种电解质溶液中。
工作原理:其中活泼的金属作负极,另一种作正极。两个电极处在同一个电解质溶液中。
2023-10-22 23:09:26
2023-10-22 23:07:11
2023-10-22 23:04:56
2023-10-22 23:02:41
2023-10-22 23:00:26
2023-10-22 05:53:13
2023-10-21 22:55:09
2023-10-21 22:52:54
2023-10-21 22:50:39
2023-10-21 22:48:24
2023-10-21 22:46:09
2023-10-21 22:43:54
2023-10-21 22:41:39
2023-10-21 22:39:24
2023-10-21 22:37:08
2023-10-21 22:34:53
2023-10-21 15:21:27
2023-10-21 15:19:12
2023-10-21 15:16:57
2023-10-21 15:14:42